谱系追踪技术犹如一把解锁生命奥秘的“时光机”,通过为每个细胞赋予独特的“条形码”,记录并分析这些信息,构建出细胞家族的“族谱”——细胞谱系树。该技术能够追溯生物体内每个细胞的起源与分化历程,揭示细胞从胚胎发育到成熟个体的动态演变过程。这项技术不仅清晰展现了细胞间的亲缘关系,还记录了它们在时间和空间上的动态变化,为深入理解发育、疾病和再生等生命过程提供了关键线索,其应用场景包括发育生物学、肿瘤研究、免疫学和再生医学等。随着单细胞测序等高新技术的不断发展,目前常见的谱系追踪技术主要有如下几种:
表1.常见谱系追踪技术原理及特点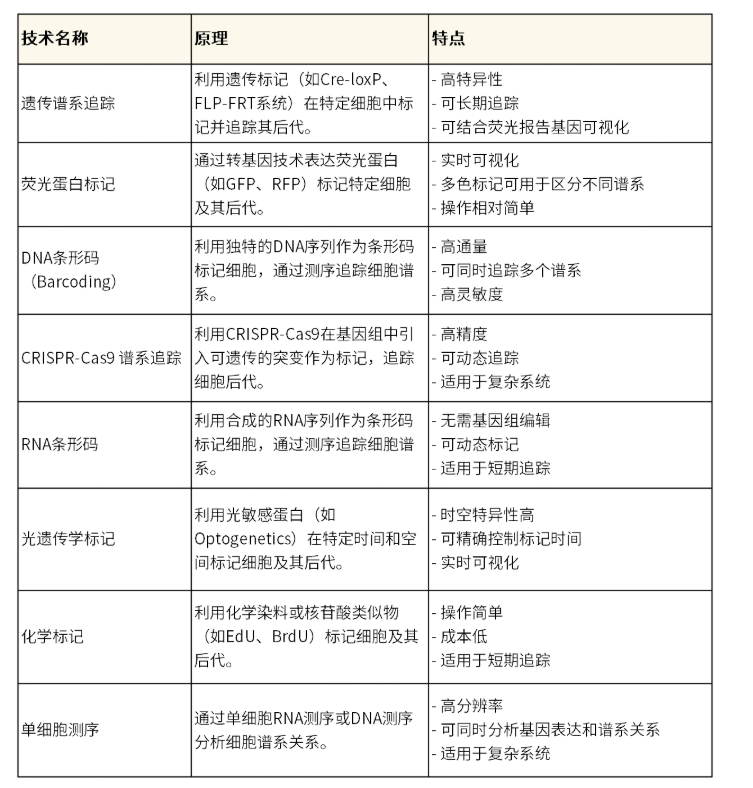
近日,中国科学院广州生物医药与健康研究院彭广敦研究团队的最新突破,为谱系追踪技术注入了新的活力。该团队成功开发出新型单细胞谱系示踪技术——DuTracer。该技术创新性地结合了CRISPR-Cas9和Cas12a两种基因编辑工具,显著提升了细胞谱系追踪的精度和深度[3]。传统的细胞谱系追踪方法,因技术限制致使信息记录不全,而基于CRISPR的基因编辑技术提高了分辨率,却存在靶点间大片段删除难题,如同在记录家族历史时丢失关键代际信息。DuTracer的创新之处在于同时利用Cas9和Cas12a两种核酸酶,并通过控制它们的激活时间,避免多靶点同时编辑引发的示踪信息丢失。实验显示,该技术在小鼠胚胎干细胞和类器官模型中大幅降低了有害删除事件,且记录的细胞分裂层级更深,能够更精准地还原细胞分化路径。
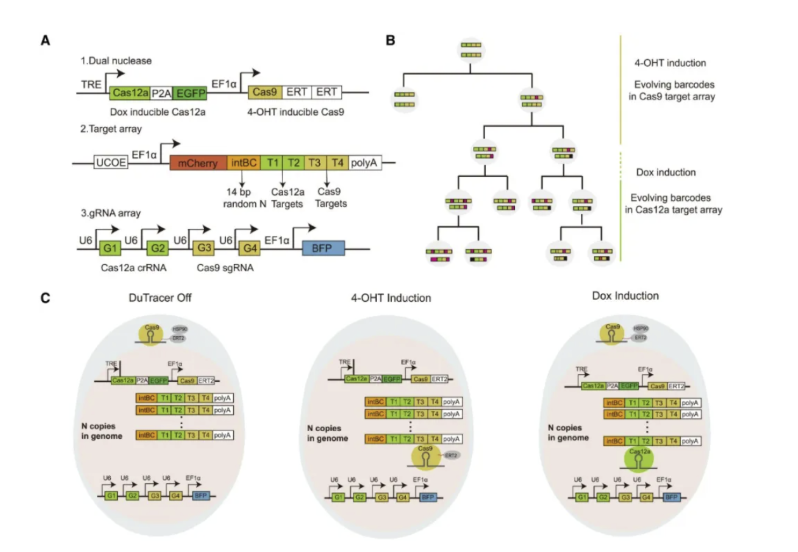
图1.DuTracer设计原理
针对基于CRISPR-Cas9等基因编辑工具的谱系追踪技术,翌圣生物可提供一系列高品质Cas蛋白及相关产品,助力研究人员更高效、更精准地完成基因编辑实验,推动细胞谱系追踪研究迈向新高度。
接下来,小编将为大家重点推荐几款明星产品,助您轻松开启科研探索之旅!
Cas9蛋白
Cas9 Nuclease (Cat#14701ES)
Cas9 Nuclease来源于野生型酿脓链球菌S. pyogenes,是依赖RNA介导的内切核酸酶,可以特异地切割双链DNA(在DNA PAM存在的情况下,也可以切割单链DNA或单链RNA)。Cas9切割位点位于目标序列内,离PAM(NGG)区3个碱基。本产品经过密码子优化及核定位信号(NLS)设计,由大肠杆菌重组表达而来,编辑效率高,可用于细胞(造血干细胞、T细胞等)的基因修饰,也可用于分子诊断,检测病原体等。
性能展示
A:体外切割测试:3批次体外切割活性均达98%以上;
B:体内基因敲除,敲除效率与进口品牌一致。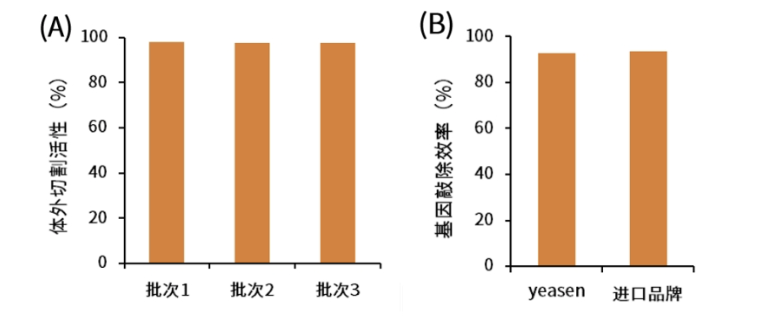
图2.Cas9 Nuclease体外切割活性及基因敲除效率结果
Cas12蛋白
ArCas12a Nuclease (Cat#14702ES)
ArCas12a核酸内切酶,源自Agathobacter rectalis细菌的CRISPR系统,别名Cpf1,是一个包含1263个氨基酸的单体蛋白。Cas12a缺乏HNH结构域,可单独利用其RuvC结构域在CRISPR RNA(crRNA)引导下识别位于靶标核酸5’端富含胸腺嘧啶(T)的PAM区而启动对靶标DNA的切割,已成功用于许多哺乳动物和植物的基因组编辑。此外Cas12a还具有反式切割活性,可不加选择地切割反应体系中的非靶标单链DNA。与LbCas12a/AsCas12a相比,ArCas12a具有更高的温度适应性(25-55℃),可适用于基因组编辑及核酸检测等。
性能展示 双链DNA高效体外切割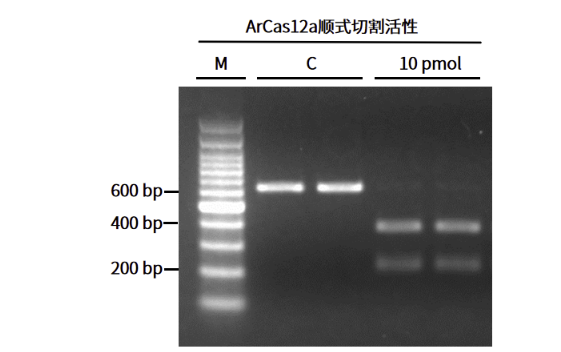
图3.ArCas12a顺式切割活性检测 M:Marker;C:模板双链DNA
注:在crRNA的引导下可高效的切割双链DNA(600 bp)产生两段切割产物(200 bp+400 bp)
反式切割活性强,可用于核酸检测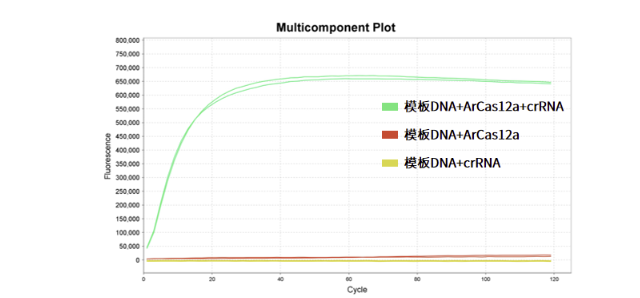
图4.ArCas12a反式切割活性检测
注:以双链DNA模板为靶标,加入ArCas12a、crRNA(存在与模板DNA序列互补的spacer区)及单链DNA报告探针(含有荧光报告基团)进行体外切割,当ArCas12a与crRNA及靶标DNA形成复合体后会激活反式切割活性,切割单链DNA报告探针,从而发出荧光。结果显示,翌圣ArCas12a与crRNA及模板DNA形成复合体后具有反式切割活性,可剪切单链DNA。
Cas12b蛋白
AapCas12b Nuclease (Cat#14808ES)
AapCas12b核酸酶(又名C2c1)是由tracrRNA:crRNA(或sgRNA)介导的DNA核酸内切酶,来源于嗜酸耐热菌Alicyclobacillus acidophilus,在靶标双链DNA存在PAM(TTN)序列的情况下,特异地剪切靶标双链DNA,使DNA双链断裂并生成粘性末端。AapCas12b可不依赖PAM序列特异地剪切单链DNA靶标。双链或单链DNA靶标均能激活AapCas12b的反式剪切活性(即旁路剪切活性/附属剪切活性),即当AapCas12b酶与sgRNA、靶标DNA结合形成三元复合物后,便会被激活针对非特异序列ssDNA的反式剪切活性,将体系中的任意序列ssDNA切碎。AapCas12b最佳剪切反应温度为60℃,比AacCas12b更耐高温,适用于与LAMP联用,开发恒温扩增/CRISPR-Cas检测体系。
性能展示 顺势切割活性:效果媲美进口品牌T*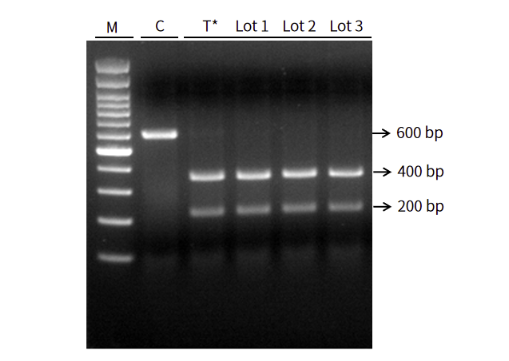
图5.AapCas12b Nuclease (10 μM)顺式切割活性验证
注:在20 μL的反应体系,含有带PMA序列的双链Target DNA、sgRNA、Cas12b和1×reaction buffer,在60°C下反应30 min,85°C下灭活5 min,在琼脂糖凝胶电泳测定结果显示,三批次AapCas12b Nuclease (10 μM) (Cat#14808ES)均能有效切割双链Target DNA,切割效果与进口品牌T*相当。
反式切割活性:能有效切割体系中的ssDNA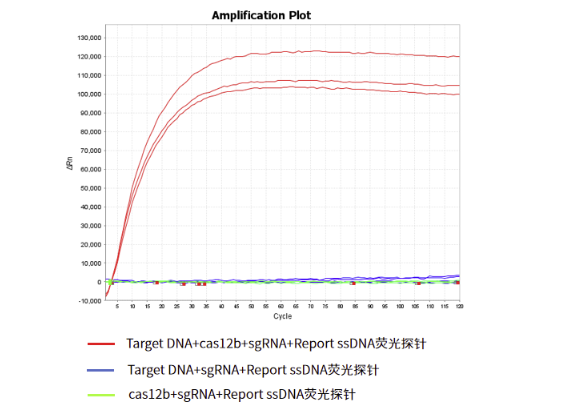
图6.AapCas12b Nuclease (10 μM)反式切割活性验证
注:在20 μL的反应体系,含有带PMA序列的双链Target DNA、sgRNA、Cas12b、Report ssDNA荧光探针和1×reaction buffer,在60℃反应1h,每30 sec采集一次荧光信号,结果显示在Target DNA、sgRNA、Cas12b共同存在的情况下,Report ssDNA荧光探针能被切割,从而释放荧光信号。
sgRNA合成试剂盒
Hifair® Precision sgRNA Synthesis Kit
(Cat#11355ES)
该试剂盒的应用极为简便,用户只需设计一条特定的上游引物,并结合试剂盒提供的其他试剂,即可在短短4小时内合成出20-100 μg高品质的sgRNA。所产生的sgRNA具备高产量、高纯度和高活性等优势,在基因编辑过程中能显著提升编辑效率,并大幅降低脱靶现象的发生几率,确保基因编辑工作以高效率和高准确性进行。
性能展示 高合成产量:单管反应4小时,sgRNA产量可达20-100 μg
图7.不同时间的sgRNA的合成量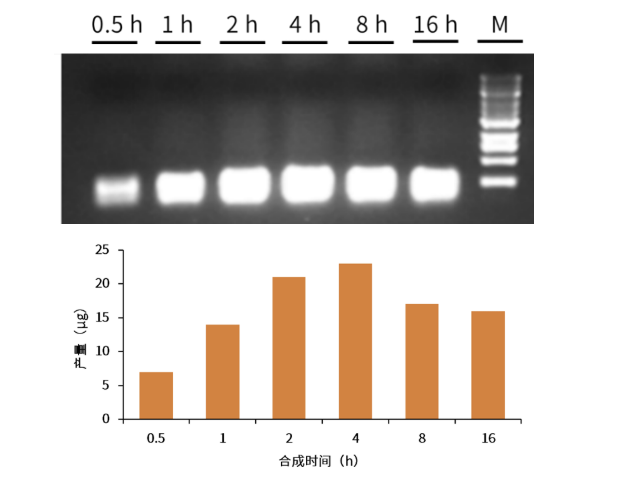
适用范围广:不同种类的sgRNA均可获得高产量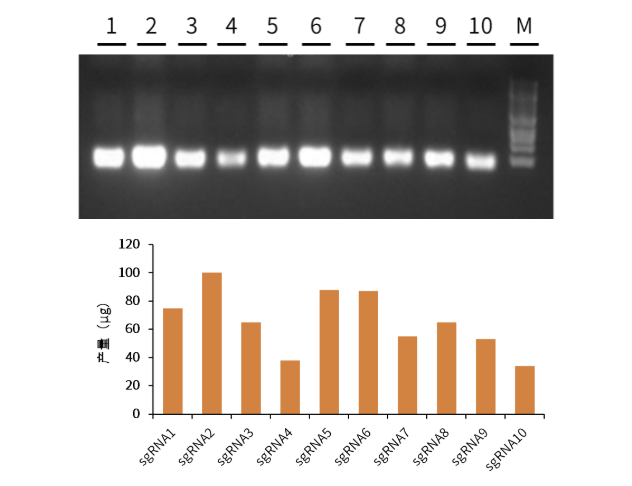
图8.不同序列的sgRNA的合成产量
高纯度:合成的sgRNA条带单一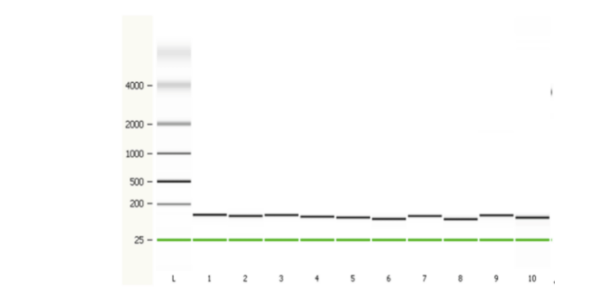
图9.合成的sgRNA的纯度(安捷伦2100测定)
高活性:合成的sgRNA可有效引导Cas9切割靶标DNA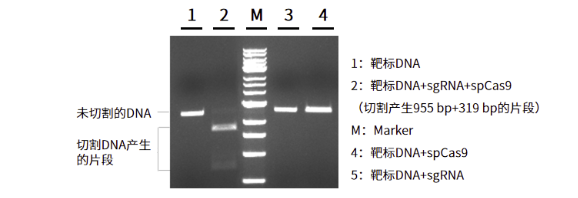
图10.sgRNA的剪切效率效果图
当前,CRISPR基因编辑技术正处于快速发展的时期,整个领域仍在不断成熟和完善中。随着科学研究和技术应用的持续推进,我们有理由相信未来将涌现出更多创新性的基因编辑工具,这些新工具将进一步拓宽该技术的应用场景与潜力。
如果您对基因编辑有任何需求或兴趣,欢迎随时联系我们。无论是在基础研究、药物开发、农业生物技术、合成生物学等领域,我们都致力于为您提供最前沿的技术支持和服务,共同探索基因编辑带来的无限可能。
基因编辑相关产品推荐
|
产品应用 |
产品定位 |
产品名称 |
产品货号 |
|
通用型 |
带NLS的SpCas9 |
14701ES |
|
|
荧光观察/流式分选 |
带EGFP荧光标签的SpCas9 |
11364ES |
|
|
基因调控 |
无剪切酶活性的Cas9 |
11351ES |
|
|
小分子量递送 |
Cas12a |
14702ES |
|
|
Cas12b |
14808ES |
||
|
sgRNA制备 |
sgRNA合成 |
11355ES |
|
|
sgRNA纯化 |
12602ES |
参考文献:
[1] Kretzschmar K, Watt F M. Lineage tracing[J]. Cell, 2012, 148(1): 33-45.
[2] Hsu Y C. Theory and practice of lineage tracing[J]. Stem Cells, 2015, 33(11): 3197-3204.
[3] Chen C, Liao Y, Zhu M, et al. Dual-nuclease single-cell lineage tracing by Cas9 and Cas12a[J]. Cell Reports, 2025, 44(1).
